Una página que describe detalladamente todos los Modelos Atómicos y las experiencias relacionadas con los distintos fenómenos descubiertos por los científicos.
http://thales.cica.es/rd/Recursos/rd99/ed99-0280-01/ejem3-parte1.html
A.Modelo atómico de John Dalton, publicada entre los años 1.808 y 1.810
John Dalton (1766-1844). Químico y físico británico. Creó una importante teoría atómica de la materia. En 1803 formuló la ley que lleva su nombre y que resume las leyes cuantitativas de la química (ley de la conservación de la masa, realizada por Lavoisier; ley de las proporciones definidas, realizada por Louis Proust; ley de las proporciones múltiples, realizada por él mismo). Su teoría se puede resumir en:

1.- Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos.
2.- Todos los átomos de un elemento químico dado son idénticos en su masa y demás propiedades.
3.- Los átomos de diferentes elementos químicos son distintos, en particular sus masas son diferentes.
4.- Los átomos son indestructibles y retienen su identidad en los cambios químicos.
5.- Los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí, en una relación de números enteros sencilla, formando entidades definidas (hoy llamadas moléculas).
B.Modelo atómico de J. J. Thomson , publicada entre los años 1.898 y 1.904

Joseph Thomson (1.856-1.940) partiendo de las informaciones que se tenían hasta ese momento presentó algunas hipótesis en 1898 y 1.904, intentando justificar dos hechos:
a.La materia es eléctricamente neutra, lo que hace pensar que, además de electrones, debe de haber partículas con cargas positivas.
b.Los electrones pueden extraerse de los átomos, pero no así las cargas positivas.

Propuso entonces un modelo para el átomo en el que la mayoría de la masa aparecía asociada con la carga positiva (dada la poca masa del electrón en comparación con la de los átomos) y suponiendo que había un cierto número de electrones distribuidos uniformemente dentro de esa masa de carga positiva (como una especie de pastel o calabaza en la que los electrones estuviesen incrustados como si fueran trocitos de fruta o pepitas).
Fue un primer modelo realmente atómico, referido a la constitución de los átomos, pero muy limitado y pronto fue sustituido por otros.
C. Modelo atómico de Rutherford, publicada en el 1.9111

Ernst Rutherford (1.871-1.937) identifico en 1.898 dos tipos de las radiaciones emitidas por el urania a las que llamo a las que llamó alfa (a) y beta (b) . Poco después Paul Villard identifico un tercer tipo de radiaciones a las que llamo gamma (n).
Rutherford discípulo de Thomson y sucesos de su cátedra, junto con sus discípulos Hans Geiger (1.882-1.945) y Gregor Marsden (1.890-1956), centraron sus investigaciones en las características de las radiactividad, diseñando su famosa experiencia de bombardear láminas delgadas de distintas sustancias, utilizando como proyectiles las partículas alfa (a) .
Sir Ernest Rutherford (1871-1937), famoso hombre de ciencia inglés que obtuvo el premio Nobel de química en 1919, realizó en 1911 una experiencia que supuso un paso adelante muy importante en el conocimiento del átomo.
 |
| Experimento de Rutherford |
La experiencia de Rutherford consistió en bombardear con partículas alfa una finísima lámina de oro. Las partículas alfa atravesaban la lámina de oro y eran recogidas sobre una pantalla de sulfuro de cinc.
La importancia del experimento estuvo en que mientras la mayoría de partículas atravesaban la lámina sin desviarse o siendo desviadas solamente en pequeños ángulos, unas cuantas partículas eran dispersadas a ángulos grandes hasta 180º.
El hecho de que sólo unas pocas radiaciones sufriesen desviaciones hizo suponer que las cargas positivas que las desviaban estaban concentradas dentro de los átomos ocupando un espacio muy pequeño en comparación a todo el tamaño atómico; esta parte del átomo con electricidad positiva fue llamado núcleo.
D. Modelo atómico de Bohr para el átomo de hidrógeno, propuesto en 1.913

A pesar de constituir un gran avance y de predecir hechos reales, el modelo nuclear de Rutherford presentaba dos graves inconvenientes:
1.Contradecía las leyes electromagnéticas de Maxwell, según las cuales, una partícula cargada, cuando posee aceleración, emite energía electromagnética.
2.Según el enunciado anterior los espectros atómicos debería ser continuos, ocurriendo que éstos son discontinuos, formados por líneas de una frecuencia determinada.
El físico danés Meils Bohn (1.885-1.962), premio Nobel de Física en 1.922 presento en 1.913 el primer modelo de un átomo basado en la cuantización de la energía. Supero las dificultades del modelo de Rutherford suponiendo simplemente que la Física clásica no se podía aplicar al universo atómico. No hay ninguna razón, decidio Bohr, para esperar que los electrones en los átomos irradien energía mientras no se les proporcione ninguna energía adicional. Igualmente los espectros atómicos de absorción y emisión de lineas eran indicativos de que los átomos, y más concretamente los electrones, eran capaces de absorver o emitir cuantos de energía en determinadas condiciones
La teoría de los cuantos de Planck la aporto a Bohr dos ideas:
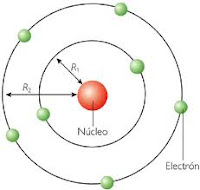 |
| Modelo Atómico de Bohr |
a.Las oscilaciones eléctricas del átomo solo pueden poseer cantidades discretas de energía (están cuantizados)
b.Sólo se emite radiacción cuando el oscilador pasa de un estado cuantizado a otro de mayor energía.
Bohr aplicó estas ideas al átomo de hidrógeno y enuncio los tres postulados siguientes:
1.En el átomo de hidrógeno el movimiento del electrón alrededor del núcleo está restingido a un número discreto de orbitas circulares (primer postulado) .
2.El momento angular del eléctrón en una órbita está cuantizado; es un número entero de h/2pi, siendo h la constante de Planck (segundo postulado).
3.El electrón no radia energía mientras permanece en una de las órbitas permitidas, teniendo en cada órbita una energía característica constante. Cuando el electrón cae de un estado de energía superior a otro de energía inferior, se emite una cantidad de energía definida en forma de un fotón de radiación (tercer postulado).
Niels Bohr (1885-1962 fue un físico danés que aplicó por primera vez la hipótesis cuántica a la estructura de los átomos.












